Science:新研究揭示GPCR信号中配体功效和效力的分子决定因素
来源:生物谷原创 2024-01-28 09:37
在一项新的研究中,研究人员通过每次替换一个氨基酸来研究β2AR,从而了解该受体中的每个氨基酸对介导信号反应的贡献。
在一项新的研究中,来自美国圣犹大儿童研究医院、斯坦福大学、加拿大蒙特利尔大学、英国皇家研究理事会分子生物学实验室和剑桥大学的研究人员利用数据科学、药理学和结构信息,对结合肾上腺素的受体---β2肾上腺素能受体(β2AR)---中的每个氨基酸在这种天然配体存在时如何促进受体活性进行了原子水平研究。他们准确地发现了哪些氨基酸控制着配体肾上腺素的关键药理特性。他们所研究的β2AR是 G 蛋白偶联受体(GPCR)家族的成员,而这一家族是美国食品药品管理局(FDA)批准的所有药物中三分之一的靶点。因此,了解 GPCR 如何对天然配体或治疗配体做出反应,对于开发精确影响受体活性的新疗法至关重要。相关研究结果近期发表在Science期刊上,论文标题为“Molecular determinants of ligand efficacy and potency in GPCR signaling”。

要了解一块手表的工作原理,可以将其逐块拆开,研究每个部件在其计时功能中所起的作用。同样,在像 GPCR 这样的蛋白中,每个氨基酸都可能在蛋白如何对外部信号做出反应的过程中发挥不同的作用。
这些作者通过每次替换一个氨基酸来研究β2AR,从而了解该受体中的每个氨基酸对介导信号反应的贡献。
论文共同通讯作者、圣犹大儿童研究医院结构生物学系的M. Madan Babu博士说,“科学家们通过逐个破坏基因来了解基因对细胞功能的贡献。我们问,‘为什么我们不更深入一层呢?让我们通过一次一个氨基酸的突变来了解每一个氨基酸是如何对受体的功能做出贡献的。’ 通过进化,β2AR中的每个氨基酸都以某种方式被塑造,以确保它能与天然配体(在本研究中为肾上腺素)结合,并引起适当的生理反应。”
在形状中寻找功能
GPCR 是跨越细胞膜的蛋白,通过向细胞内部传递外部信号,将细胞外部与细胞内部环境连接起来。以β2AR为例,肾上腺素与这种GPCR位于细胞外部的部分结合,诱发细胞内部的反应。
当配体结合时,会导致β2AR的形状发生变化,尤其是在β2AR中与 G 蛋白结合的细胞内区域。配体和 G 蛋白的结合位点位于β2AR的两侧,但通过横跨这整个蛋白的复杂的氨基酸接触网络连接在一起。β2AR的构象(形状)变化会激活 G 蛋白,从而触发细胞内的下游信号反应。通过对多个组织和 GPCR(包括β2AR)的影响,肾上腺素可以触发“要么战斗,要么逃跑”的反应,例如在肾上腺素激增时。
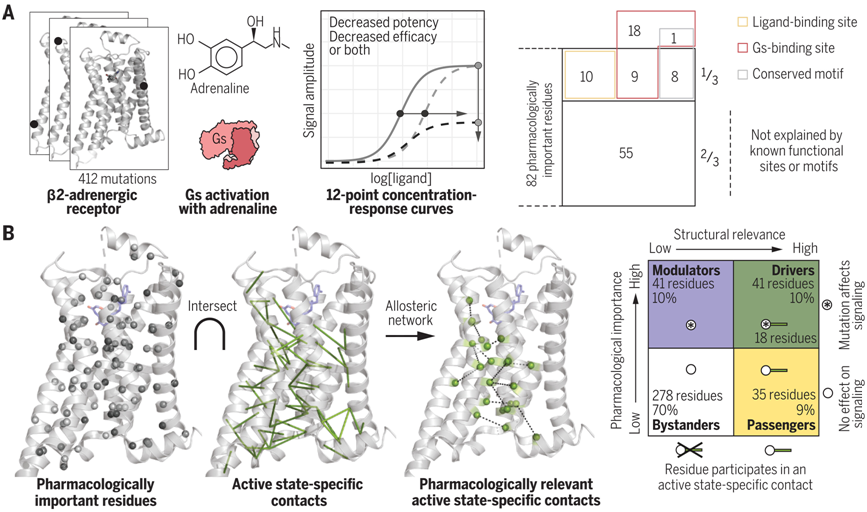
为了了解 GPCR 中每个氨基酸的作用,论文第一作者兼论文共同通讯作者、马尔堡菲利普大学的 Franziska Heydenreich 博士对 β2AR 中的 412 个氨基酸逐一进行了突变。然后,她评估了每个突变体对配体肾上腺素的反应,并确定了功效和效力的经典药理学特性。功效(efficacy)衡量配体能引起的最大反应,效力(potency)衡量引起最大反应一半所需的配体量。这项研究的目的是在原子尺度上揭示每个氨基酸对这两种药理特性的贡献。
Heydenreich 说,“令人惊讶的是,在 400 多个氨基酸中,只有约 80 个氨基酸对这两种药理特性有贡献。在这些与药理相关的氨基酸中,只有三分之一位于配体或 G 蛋白与受体结合的区域内。”
一种配体-受体-信号系统中功效和效力的决定因素和分子起源。图片来自Science, 2023, doi:10.1126/science.adh1859
Babu说,“观察到有一些氨基酸控制功效,一些氨基酸控制效力,还有一些氨基酸对两者都有影响,这很有意思。这意味着,如果你想制造功效或效力更好的药物,你如今知道一种新的配体需要影响哪些特定氨基酸残基了。”他们还注意到,每个氨基酸残基对功效和效力的贡献并不相同,这意味着在设计新的治疗配体时,有更多机会对药物反应进行微调。
Babu解释说,“几十年来,我们一直在测量许多配体-受体信号系统的功效和效力。如今,我们可以了解蛋白序列中的特定氨基酸如何影响这两种药理特性。”
这些研究结果的一个迷人之处在于,功效和效力可以通过不同的机制相互独立地调节。论文共同通讯作者、蒙特利尔大学生物化学与分子医学系的Michel Bouvier 博士补充说,“这为了解遗传变异如何影响不同个体间的药物反应提供了基础。”
美丽的网络
先前的研究说明了β2AR的活性状态和非活性状态的结构。在此基础上,这些作者开始了这项新的研究。他们探索了之前被证明不参与配体或G蛋白结合的三分之二药理相关氨基酸是否会在这种受体的活性和非活性状态之间的转换中发挥作用。
Heydenreich说,“我们开始系统地研究β2AR活性状态特有的每一个氨基酸残基接触,以了解是否所有进行活性状态接触的氨基酸都很重要。”
这些作者开发了一个数据科学框架,系统地整合了药理学和结构学数据,首次揭示了GPCR信号传导的全貌。Babu说,“当我们把药理学数据对应到结构上时,它们形成了一个美丽的网络。”
论文共同通讯作者、斯坦福大学医学院的Brian Kobilka补充说,“这为我们提供了新的视角,让我们了解配体结合口袋与 G 蛋白结合位点之间的异构网络,该网络制约着功效和效力。”
通过在原子水平上理解GPCR信号传导,这些作者乐观地认为,他们可以开始更深入地探索---观察活性构象和非活性构象之间的瞬时亚状态,并探索蛋白的构象图谱。Heydenreich说,“我们如今知道要研究哪些突变体了,哪些突变体只会影响功效、效力或两者兼而有之。”
Babu解释道,“如今,我们可以对这些突变体进行分子动力学计算和单分子实验,以揭示这个异构网络影响功效和效力以介导信号反应的确切机制。这是我们正在通过圣犹大GPCR 研究合作组织研究的一个方向。”
除了这些参与介导活性状态特异性接触并在突变时影响药理学的“驱动(driver)”氨基酸残基外,Babu和他的同事打算探索这项研究揭示的其他关键发现。他们的目标是研究“乘客(passenger)”氨基酸,尽管在活性状态下进行接触,但是当发生突变时不会影响功效或效力。
他们还对“调节(modulator)”氨基酸残基感兴趣,这些残基不介导活性状态特异性接触,但发生突变后会改变药理学。他们的数据科学方法整合了结构信息和药理学测量,并不局限于β2AR。它可以扩展到任何 GPCR,以加强人们对这一类重要药物靶点的机制的了解。(生物谷 Bioon.com)
参考资料:
Franziska M. Heydenreich et al. Molecular determinants of ligand efficacy and potency in GPCR signaling. Science, 2023, doi:10.1126/science.adh1859.
GPCR structure: Research reveals molecular origins of function for a key drug target
https://phys.org/news/2023-12-gpcr-reveals-molecular-function-key.html
版权声明 本网站所有注明“来源:生物谷”或“来源:bioon”的文字、图片和音视频资料,版权均属于生物谷网站所有。非经授权,任何媒体、网站或个人不得转载,否则将追究法律责任。取得书面授权转载时,须注明“来源:生物谷”。其它来源的文章系转载文章,本网所有转载文章系出于传递更多信息之目的,转载内容不代表本站立场。不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。


